Apolipoproteínas
As
apolipoproteínas ( apo ) desempenham importantes funções no
metabolismo lipoproteico, nomeadamente no transporte dos lípidos no
meio aquoso plasmático, na ligação aos receptores de superfície
com a finalidade de dirigir os lípidos para os órgãos e tecidos
alvos, bem como na activação ou inibição das enzimas
intervenientes no metabolismo lipídico.
A
apo A-I representa cerca de 45% da massa molecular da partícula HDL,
actuando como cofactor da LCAT, bem como mediador da transferência
do colesterol das células para os HDL, processos estes relevantes no
transporte reverso do colesterol.
A
apo B é a principal proteína funcional no transporte do colesterol
para as células periféricas, sendo que a apo B constitui cerca de
90% da fracção proteica do LDL.
A
relação apo B/apo A-I dá o balanço entre partículas de
colesterol potencialmente aterogénicas ( apo B ) e as partículas do
colesterol anti-aterogénico ( apo A-I ).
O
valor preditivo das apo A-I e apo B foi verificado, em alguns
estudos, ser superior ao dado pelo doseamento dos lípidos e
lipoproteínas, e a relação apo B/apo A-I mostrou, em alguns casos,
o melhor valor preditivo para o risco de doença cardiovascular e
doença aterosclerótica.
O
doseamento plasmático das apo mostra vantagem sobre o das
lipoproteínas por aquelas serem feitas de modo directo enquanto que,
nomeadamente a LDL, é obtida por meio indirecto através da fórmula
de Friedewald, sendo deste modo mais sujeita a erros. As
concentrações plasmáticas das apo apresentam pouca influência de
variáveis biológicas enquanto que as dos lípidos mostram
flutuações das concentrações plasmáticas em resposta a diversos
estímulos do controlo metabólico, pelo que variáveis
pré-analíticas influenciam menos no doseamento das apo A-I e apo B,
que não necessitam de jejum prévio para a correcta determinação.
Em
doentes com níveis de LDLᴄ
desejáveis, o doseamento da apo B mostra-se melhor marcador de risco
cardiovascular do que a LDLc, para ambos os sexos.
A
variável isolada mais fortemente associada a uma subida do risco de
enfarte agudo do miocardio fatal, foi verificado ser a relação apo
B/apo A-I, e este facto acentua-se quando o doente apresenta lipémia
dentro dos valores desejáveis.
O
índice colesterol total/HDLc subestima, de forma apreciável, o
risco cardiovascular.
Estudo
em mulheres mais velhas do que 45 anos concluiu que o doseamento do
colesterol não-HDL e o índice colesterol total/HDLc apresentam
eficácia sobreponível à observada pelo doseamento das apo B e apo
A-I e a relação apo B/apo A-I na predição do risco
cardiovascular. A apo B mostrou ser o melhor parâmetro isolado na
previsão de eventos cardiovasculares futuros em mulheres.
Agentes
hipolipemiantes, e particularmente estatinas, têm acção importante
sobre o perfil apolipoproteico, alguns mostrando redução
significativa dos níveis de apo B enquanto outros determinam aumento
dos níveis de apo A-I e outros actuam sobre ambas as apos ( apo B e
apo A-I ), pelo que o tratamento com estes agentes se apresenta
potencialmente como factor de correcção do balanço anormal entre
as lipoproteínas aterogénicas e anti-aterogénicas, balanço este
intimamente associado ao risco cardiovascular.
Foram
sugeridos os pontos de corte, para homens e mulheres, de
respectivamente 0.9 e 0.8, sendo que valores inferiores a estes
indicam um menor risco de doença cardiovascular.
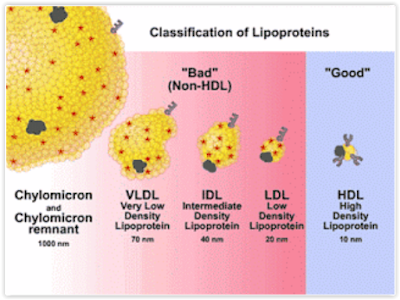
Todas
as lipoproteínas que contêm apo B apresentam-se estruturalmente
como um núcleo ( core ) formado de triglicerídeos e ésteres de
colesterol revestidos por uma monocamada superficial formada por
fosfolípidos, colesterol não esterificado e apolipoproteínas.
Enquanto
a VLDL apresenta as apo B100, C-I, C-II e E, já a LDL apresenta em
mais de 90% a apo B100 sendo a LDL a responsável pelo transporte da
maior parte do colesterol.
Via exógena de montagem das lipoproteínas
Nas
quilomicra há predomínio de triglicerídeos sobre o colesterol no
core da partícula. Os triglicerídeos são hidrolisados pela LPL no
core das quilomicra, libertando ácidos gordos livres captados pelo
tecido adiposo e músculos. Durante esta hidrólise o quilomicron
diminui de tamanho, sendo transferidos alguns componentes
superficiais para as HDL, e o restante constitui o remanescente do
quilomicron, que adquirindo apo E proveniente da HDL é captada pelo
hepatócito, sendo a partícula degradada e libertando o colesterol
da dieta no fígado.
É
esta a via exógena de montagem e catabolismo das lipoproteínas.
Via endógena de montagem das lipoproteínas
Na
via endógena é a VLDL a interveniente que origina a LDL, passando
pelo estado intermédio da IDL, e isto pela interacção da LPL sobre
a VLDL no endotélio capilar, sendo o triglicerídeo hidrolisado e
originando os ácidos gordos que se dirigirão, tal como na via
exógena das quilomicra, para tecido adiposo ( armazenamento ) ou
músculo ( energia ).
Conforme
a IDL se transforma em LDL, a apo E se liberta, permanecendo
unicamente a apo B100 na partícula. De salientar que cada partícula
desta cascata, desde a VLDL até LDL passando pela IDL, apenas contém
uma apo-B100.
Na
hidrólise das quilomicra, bem como da VLDL, a apo C-II permite esta
hidrólise dos triglicerídeos pela LPL enquanto a apo E acelera a
captação pelo fígado dos remanescentes.
De
referir que os quilomicra contêm a forma apo B-48 enquanto que as
VLDL apresentam a forma completa apo B-100. Os remanescentes das
quilomicra são degradadas após terem sido absorvidas pelo
hepatócito, ao contrário dos remanescentes da VLDL que tendem a ser
processados a nível dos sinusóides hepáticos para se
transformarem em LDL.
Lipoproteína
(a ) ou Lp(a) é uma classe de partículas de lipoproteínas de
síntese hepática possuindo composição lipídica semelhante à
LDL. A LDL distingue-se da Lp(a) pela presença da lipoproteína [
apo(a)], proteína estruturalmente homóloga à do plasminogéneo.
Níveis altos da apo(a) têm acção aterogénica e pro-trombótica.
Os níveis plasmáticos do Lp(a) são praticamente determinados na
totalidade pela variação genética do Lp(a).
As
principais apos da HDL são a apo A-I e apo A-II formadas no fígado
e intestino delgado.

A
maioria das apos e fosfolípidos que originam a HDL nascente são
secretados inicialmente na superfície das quilomicra e VLDL. Depois
da LPL hidrolisar o triglicerídeo em quilomicra e VLDL, o conteúdo
lipidíco do núcleo torna-se menor, ocorrendo redundâncias de
colesterol não éster e fosfolípido na camada superficial, sendo
estes componentes redundantes de superfície transferidos para HDL.
As HDL-nascentes também captam o excesso de colesterol não éster e
fosfolípidos dos tecidos periféricos. Este colesterol de HDL é
esterificado pela LCAT, que é activada pela apo A-I na superfície
da HDL esterificando o colesterol livre, fazendo com que entre para o
core. A partícula de HDL-nascente se transforma em HDLз,
maior e mais flutuante, que progride para HDL2,
ainda maior. A apo A-II pode ser adicionada a HDL2
destinada ao transporte de colesterol éster para o fígado por meio
da proteína transferidora do colesterol éster ( CETP ). A lipase
hepática da superfície do fígado hidrolisa o fosfolípido e o
triglicerídeo da HDL2
diminuindo o tamanho desta e que vai originar a
HDL, ainda menor.

A
lipase hepática liga-se ao endotélio dos sinusóides hepáticos e
actua nas lipoproteínas. Hidrolisa os fosfolípidos e triglicerídeos
da LDL e HDL originando as LDL pequenas e densas e, por outro lado,
converte HDL2 em
HDLз.
Raramente
aterosclerose estabelecida não cursa com anormalidades lipoproteicas
ou lipídicas detectáveis. A quantificação da apo B e Lp(a) revela
muitas vezes a presença de alterações lipoproteicas mínimas, como
por exemplo LDL pequena e densa.
Verificou-se
existir uma associação entre HDLc e a prevalência e gravidade da
doença coronária.
Estudo
efectuado no Brasil demonstrou que concentrações séricas mais
elevadas de triglicerídeos e/ou VLDLc e mais baixos da HDLc e/ou apo
A estão em paralelo com maior gravidade de doença coronária.
O
LDL oxidado difere do LDL nativo dado as proteínas e lípidos que a
constituem encontrarem-se modificadas por espécies reactivas de
oxigénio ( anião superóxido, radicais hidroxilo e peróxidos ) que os macrófagos, entre outras células, produzem.
A
LDL oxidada contribui em maior grau para o desenvolvimento de lesões
ateroscleróticas do que o LDL nativo, dado que pela presença do
factor quimiotático nos LDL oxidados pode haver up take de LDL
oxidado pelos monócitos da circulação. Este factor quimiotático
não se encontra no LDL nativo. A mobilidade dos macrófagos, bem
como a sua capacidade de saírem da íntima, são reduzidas pelo
factor quimiotático dos LDL oxidados, levando à produção de
células esponjosas. Episódios trombóticos podem ser originados
pela citotoxicidade dos LDL oxidados que levam à perda da
integridade do endotélio.
As
apolipoproteínas são as responsáveis pela estabilização da
estrutura lipoproteica, desempenhando funções várias no
metabolismo dos lípidos como reguladores da actividade enzimática
da lipase hepática, LPL e LCAT ou agindo como sinal mediador de
endocitose.
O
risco de aterosclerose liga-se mais fortemente ao número de
partículas aterogénicas circulantes que entram em contacto e entram
na parede da artéria comparativamente com a quantidade de colesterol
existente nas lipoproteínas.
Os
níveis plasmáticos das apo dão melhor informação sobre o risco
de doença cardiovascular do que as lipoproteínas, pois as
concentrações plasmáticas das apo são determinadas geneticamente,
e assim sofrem pequena variação pelas variáveis biológicas,
enquanto que as flutuações plasmáticas dos lípidos são mais
influenciáveis por estas variáveis biológicas.
A
apo A-II, uma das apo mais abundantes no HDL, é exclusivamente
sintetizada no fígado sob a forma de preproapo A-II que é clivada
em proapo A-II que posteriormente origina a apo A-II presente, sob a
forma dimérica, no plasma. A apo A-II tem a capacidade de inibir
LCAT ( prejudicial ), inibir a actividade da CTEP ( benéfico ) e
inibir a captação do colesterol pelo fígado ( prejudicial ).
A
apo A-II tem a capacidade de inibir o efluxo do colesterol celular no
metabolismo do HDL e consequentemente aumentar o risco de
aterosclerose.
Apo
A-II tem uma acção pro-inflamatória por estimular a formação de
hidroperóxidos lipídicos nas células da parede arterial e induzir
a transmigração monocitária, não se observando que a apo A-II
proteja a oxidação.
Apo
A-IV participa no transporte reverso do colesterol tendo desta forma
acção anti-aterosclerótica activando LCAT, incrementa a actividade
da CETP e liga e capta os HDL pelos hepatócitos.
Apo
A-V tem uma relação inversa com a trigliceridemia podendo reduzir a
concentração plasmática dos triglicerídeos.
Valores
altos da razão apo B/apo A-I encontram-se frequentemente em
indivíduos obesos.
A
apo(a), estruturalmente homóloga ao plasminogéneo, é um inibidor
fisiológico deste e por isto pode originar um estado de
pré-coagulação, sendo assim a apo(a) considerada aterogénica e
factor de risco de doença coronária. A apo(a) apresenta-se em
várias isoformas sendo de maior risco de doença cardiovascular as
isoformas mais pequenas.