Procalcitonina
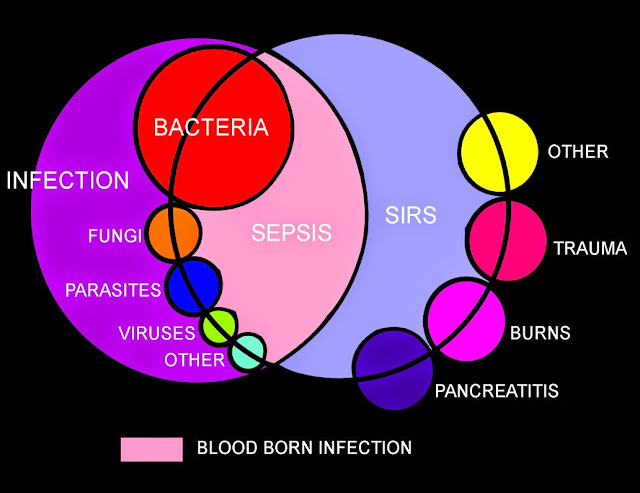
Um marcador novo, de fase aguda, usado para o diagnóstico e monitorização dos processos inflamatórios de etiologia bacteriana, e particularmente a sépsis, é a procalcitonina.
As infecções bacterianas podem apresentar sintomatologia escassa e inespecífica. As culturas são exames que requerem tempo, não refletindo sempre a resposta da inflamação sistémica do doente nem disfunção orgânica que possa surgir.
Os exames bacteriológicos culturais podem dar resultados falsos negativos.
Síntese
da procalcitonina em condições Síntese
da procalcitonina em condições
fisiológicas patológicas
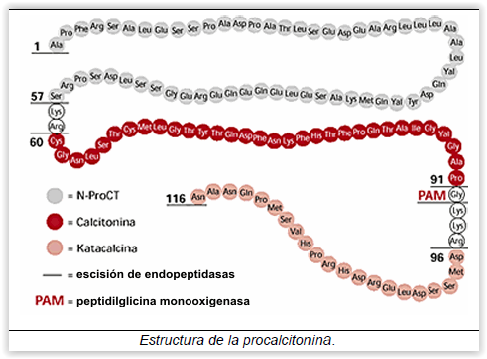
A calcitonina e a pró-hormona sua precursora, procalcitonina ( PCT ) são proteínas distintas. Enquanto a calcitonina é sintetisada exclusivamente nas células C tiroideias, após proteólise da PCT e como resposta a estímulos normais hormonais, a PCT é sintetizada em vários tipos celulares e em vários órgãos em resposta a diversos estímulos pró-inflamatórios, sendo principalmente, mas não exclusivamente, a estímulos bacterianos.
A PCT aparece na via sanguínea, não lisada, nos casos de infecções bacterianas graves.
A PCT aparece na via sanguínea, não lisada, nos casos de infecções bacterianas graves.
A PCT é um peptídeo muito estável, com semi-vida de 24 horas ( 30 - 45 horas em doentes com doença renal grave ) e formado por 116 amino-ácidos.
A PCT é uma proteína muito estável in vitro sendo muito resistente ao manuseamento pré-analítico e armazenamento, não sendo necessárias condições particulares para estas situações. A concentração sérica da PCT, em indivíduos saudáveis, é da ordem dos 0.05 - 0.1 ng/ml, subindo para valores de 20 - 200 ng/ml ou mesmo 1000 ng/ml em situações patológicas como febre séptica, febre séptica severa ou choque séptico.
Concentrações séricas de PCT de 0.5 ng/ml são consideradas concentrações altas sugerindo síndrome infeccioso bacteriano. Valores de PCT sérico da ordem dos 0.5 ng/ml a 2.0 ng/ml são considerados valores numa zona cinzenta e, como tal, incerta quanto à etiologia bacteriana do estado febril, sendo aconselhável repetir o doseamento às 6 horas e de novo às 24 horas. Valores de concentração sérica de PCT superiores a 2.0 ng/ml são fortemente indicativos de estarmos em presença de um processo infeccioso sistémico.
Valores de concentração sérica de PCT da ordem dos 10 ng/ml ou mais, quase exclusivamente se encontram em situações de infecções bacterianas graves ou choque séptico.
Fortes estímulos para a produção de procalcitonina são as citoquinas pró-inflamatórias e as endotoxinas bacterianas. A procalcitonina pode ter uma função patogénica nos estados febris de etiologia bacteriana embora ainda, com toda a certeza, seja desconhecida a função exacta da procalcitonina. Sabe-se contudo que a procalcitonina apresenta acção de quimioatracção leucocitária e de regulação da produção do óxido nítrico pelas células do endotélio vascular.
Verifica-se um forte aumento da concentração plasmática da PCT nos doentes com febre séptica severa ou choque séptico, seja durante o estado febril como, e principalmente, nos dias iniciais após esse estado febril. Em doentes com SRIS de etiologia não bacteriana verifica-se que as concentrações de PCT se encontram nos limites dos valores baixos ( < 0.1 ng/ml ). Observa-se, no entanto, subida de concentração de PCT nas situações de politraumatismos, pós-grandes cirurgias ou nos grandes queimados, assim como nos recém-nascidos, e esta subida verificada é independente dum processo infeccioso.
Os valores das concentrações da PCT normalizam de forma rápida e uma nova subida pode indicar um desenvolvimento de febre séptica.
Rejeição de transplante, doenças auto-imunes, alergias, infecções localizadas, colonização bacteriana ou infecções virais não fazem subir de modo significativo a concentração da procalcitonina ( valores < 0.5 ng/ml )
A sintomatologia habitual das infecções localizadas ou sistémicas não se manifesta e, geralmente, nos doentes com neutropenia febril, é a febre o único indicador de estarmos na presença de uma infecção bacteriana grave. Assim, neutropenia febril é uma urgência médica na qual o tratamento precoce com antibióticos pode fazer a distinção entre a sobrevivência e a morte do doente. De salientar, no entanto, que até cerca de metade dos doentes com neutropenia febril apresentam uma evolução favorável sem que seja descoberto o foco infeccioso e, nestes casos, a suspensão da terapêutica com antibióticos é a medida certa a tomar.
Diferentes marcadores de infecção foram estudados para os doentes com neutropenia febril ( PCR, IL-6, IL-8, PCT ) não existindo ainda um marcador sérico ou biológico com capacidade para indicar eficazmente estarmos em presença ou ausência de uma infecção, e não se verificou haver utilidade dos biomarcadores no manuseamento dos doentes com neutropenia febril.
Diferentes marcadores de infecção foram estudados para os doentes com neutropenia febril ( PCR, IL-6, IL-8, PCT ) não existindo ainda um marcador sérico ou biológico com capacidade para indicar eficazmente estarmos em presença ou ausência de uma infecção, e não se verificou haver utilidade dos biomarcadores no manuseamento dos doentes com neutropenia febril.
As recomendações mais actuais relativas aos doentes com neutropenia febril ( geralmente doentes com neoplasias a fazerem quimioterapia ) não sugerem o doseamento das concentrações dos biomarcadores de inflamação, nomeadamente PCR ou PCT, com o objectivo de conduzirem a terapêutica antibiótica.
Foi demonstrada a utilidade da PCT como parâmetro diagnóstico e de follow-up da antibioterapia em infecções nosocomiais ou adquiridas na comunidade, mas o mesmo não se verificou, até hoje, em doentes severamente imunocomprometidos como os que fazem quimioterapia.
A eliminação da PCT é feita principalmente pela acção de enzimas proteolíticas tendo a clearance renal uma acção menor nesta função de eliminação.
Infecção bacteriana sempre acompanha, posteriormente, uma subida da PCT, em doentes com neutropenia febril, mesmo que essa subida se verifique antes da sintomatologia de infecção bacteriana.
Uma concentração elevada de PCT em doentes com neutropenia febril tem uma boa correlação com uma probabilidade mais elevada de cursar com infecção sistémica grave comparativamente com doentes em que o valor da PCT sérica era normal, em que a probabilidade é baixa, de fazerem uma infecção sistémica.
Os doentes com PCT elevada apresentam uma mortalidade muito superior em comparação com a verificada nos doentes com concentração baixa de PCT
Nas crianças, a PCT é o biomarcador de infecção bacteriana mais específico, sendo usado na orientação e duração da antibioterapia tanto nos doentes com infecção de gravidade moderada como de gravidade crítica. Estes dados, no entanto, não se verificam, de igual forma, nos doentes com neutropenia.
P.S.: dois
princípios são usados na determinação laboratorial da
procalcitonina:
- imunocromatografia de um passo ( método quantitativo ou semi-quantitativo )
- imunoluminometria